|
reklama

| Chronická myeloidní leukemie jako příklad cílené terapie |
|
MUDr. Hana Klamová CSc. |
| SANQUIS č.78/2010, str. 71 |
 |
zpět na výběr odborných článků |
| Důležitou součástí léčby solidních nádorů a hematologických malignit se v posledních letech stává zcela nový způsob terapie, směrované na definované molekulární cíle, označovaný jako „cílená léčba“. Co si pod tímto pojmem, v zahraniční literatuře uváděným jako „targeted therapy“, můžeme představit?
|
|
Jednoduše řečeno, jedná se o léčbu zcela novými přípravky, o přesně definované chemické látky, které cíleně zasahují – na rozdíl od klasické chemoterapie – do složitých reakcí a procesů v buňce. Tato léčba u řady nemocí doplňuje nebo zcela nahrazuje klasickou chemoterapii, používanou v léčbě většiny nádorových onemocnění. Nevýhodou klasické chemoterapie je její nespecifický účinek, kdy cytostatika ničí nejen dělící se nádorové buňky, ale také buňky normální, zdravé, což pak způsobuje mnoho nežádoucích účinků. Cílená léčba naopak působí převážně na buňky nádorové a cíleně tak zasahuje do nitrobuněčných pochodů, které v konečné fázi vedou k přeměně normální buňky v buňku nádorovou.
Jedním z prvních oborů, ve kterém probíhal intenzivní výzkum v této oblasti, byla hematoonkologie a onemocněním, u kterého byl výzkum poprvé doveden až k zavedení do klinické praxe, je chronická myeloidní leukemie (CML).
CML je klonální porucha kmenové buňky pro krvetvorbu, kdy převažuje její diferenciace do myeloidní řady. Tvoří 15–25 % všech leukemií dospělého věku a její celková incidence je 0,6 až 2 nové případy onemocnění na 100 000 obyvatel za rok. Medián věku v době stanovení diagnózy je 55–60 let, výjimkou však nejsou nemocní výrazně mladší ani vyšší věkové kategorie.
CML je charakterizována přítomností translokace mezi dlouhými raménky chromozomů 9 a 22, t(9,22)(q34,q11) známé jako filadelfský chromozom. Důsledkem translokace je vznik fúzního genu BCR-ABL, který syntetizuje chimérický protein bcr-abl s deregulovanou aktivitou tyrosinkinázy (TK). Bylo prokázáno, že jeho exprese je nezbytným a pravděpodobně také dostatečným předpokladem vzniku transformovaného fenotypu CML (viz schéma B na další straně). A právě nové poznatky v oblasti molekulární biologie a genetiky tak výrazně přispěly k vývoji nejnovějších léčebných postupů.
Léčba CML zpočátku nebyla příliš úspěšná. Do 60. let minulého století se jednalo pouze o víceméně paliativní léčbu busulfanem, arsenikem, ozařováním sleziny, v 70. letech o konvenční chemoterapii hydroxyoureou, na konci 70. let pak pro určitou, přesně definovanou skupinu nemocných přibyla možnost první skutečně kurativní léčby alogenní transplantací kmenových buněk krvetvorby (TKB). V první polovině 90. let byl objeven interferon alfa (IFN-alfa), kdy až 30 % nemocných dosahovalo obrazu kompletní cytogenetické odpovědi (CCyR) a celkové přežití nemocných (OS) se prodloužilo na 66–88 měsíců.
První efektivní látky
Nové poznatky v molekulární biologii a patofyziologii CML pohled na možnosti její léčby výrazně změnily. Důležitou oblastí zájmu se stala BCR-ABL tyrosinkinázová aktivita a vývoj efektivních inhibitorů tyrosinkinázy (TKI). První látkou, která byla za skutečně cílenou léčbu označena, je tyrosinkinázový inhibitor 1. generace imatinib (IM), pak následovaly další TKI, a to dasatinib a nilotinib.
Objevení imatinibu bylo zcela zásadní změnou léčby nemocných s CML. Molekula IM je schopná specificky inhibovat enzymatickou aktivitu bcr/abl kódované tyrosinkinázy a proliferaci nádorových buněk. Působí jako kompetitivní inhibitor vazebného místa BCR-ABL pro ATP. Touto vazbou selektivně, ale současně reverzibilně blokuje fosforylaci substrátů a abnormální aktivaci signálních drah leukemické buňky a vede tak k přerušení následného děje, vedoucího k maligní transformaci buňky v buňku nádorovou, a tedy rozvoji obrazu CML (viz schéma A ).
|
|
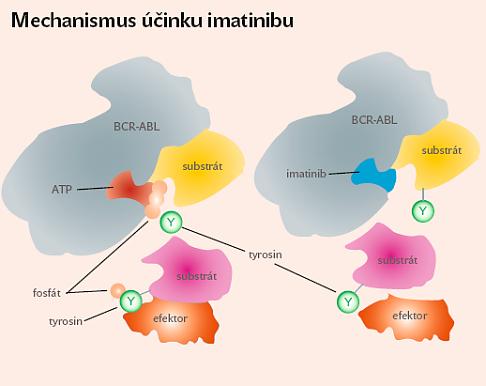 | | Schéma A: Selektivní blokování leukemické tyrozinkinázy
imatinibem, vlevo situace před podáním léku, vpravo
po podání léku, BCR-ABL – abnormální gen, produkující
nadměrné množství tyrosinkinázy |
|
|
|
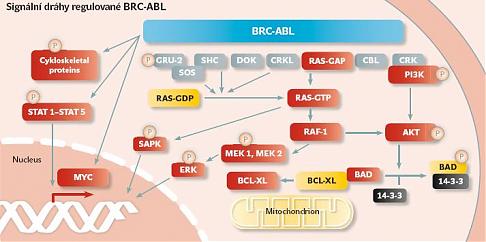 | | Schéma B: zdroj Deininger M. W. N. et al., Blood 15, 3343–3356 (2000) |
|
|
Po řadě let výzkumu a experimenálního podávání byl imatinib v roce 2001 zaveden do klinické praxe a znamenal skutečně revoluční změnu léčby CML. Výrazně se tak například prodloužilo celkové přežití (OS) nemocných v chronické fázi (CP) onemocnění na 174 měsíců (14,5 let). Imatinib byl zpočátku podáván nemocným s CML, u kterých nedostatečně účinkoval nebo nebyl tolerován IFN-alfa. Jeho vysoká účinnost u nemocných s nově diagnostikovaným onemocněním byla jednoznačně prokázána v mezinárodní klinické studii fáze III s názvem IRIS (International Randomized Study of Interferon and STI571). Aktualizované výsledky po osmi letech sledování těchto pacientů hovoří o pravděpodobnosti celkového přežití v 85 %, při hodnocení úmrtí jen v souvislosti s CML dokonce v 93 %. Pravděpodobnost přežití bez progrese (PFS) do pokročilejších stadií, kterými je akcelerovaná fáze a blastický zvrat, je 81 %.
Obdobných, tedy stejně výborných výsledků je dosahováno při terapii imatinibem také v reálné klinické praxi, což můžeme potvrdit i na souboru více než 180 nemocných, léčených tímto lékem na našem pracovišti – v Ústavu hematologie a krevní transfuze. Imatinib je tedy v současné době všeobecně uznávaným a doporučeným lékem první volby u nemocných s CML. Klinicky se manifestující nežádoucí účinky v průběhu léčby jsou většinou zvládnutelné symptomatickou léčbou, jen v některých případech dočasným přerušením léčby.
I přes vysokou účinnost a dobrou snášenlivost však u některých pacientů dochází po určitě době k rozvoji rezistence, kdy pacient již ne zcela optimálně odpovídá na léčbu a hovoříme o jejím selhání. Proto bylo mnoho sil věnováno výzkumu a vývoji dalších molekul charakteru tyrosinových kináz, tzv. TKI druhé generace, kterými jsou dasatinib a nilotinib.
Dasatinib je látka odlišné struktury než imatinib. Váže se na BCR-ABL a inhibuje také Src kinázy, proto lze hovořit o duálním Src/Abl kinázovém inhibitoru neboli multikinázovém inhibitoru. Je účinný u většiny mutovaných forem kinázy BCR-ABL, efektivní u 21 z 22 testovaných mutací. U tzv. divokého typu BCRABL je 325krát účinnější než imatinib. Výsledky pěti klinických studií s názvem START, kdy byl dasatinib podáván v různých fázích onemocnění pacientům, kde selhala předchozí léčba imatinibem, též prokazují velké procento cytogenetických a molekulárních odpovědí a přežití bez progrese nemoci. Jsou již také vyhodnocovány klinické studie, kdy je dasatinib podáván u nově diagnostikovaných nemocných. V ČR je dostupný pod názvem Sprycel.
Nilotinib, syntetický kompetitivní inhibitor BCR-ABL tyrosinové kinázy, byl vyvinut jako strukturální modifikace imatinibu (viz schéma C). Má více než 20krát větší vazebnou kapacitu než imatinib a působí také na většinu mutantních forem BCR-ABL. V České republice je možné jej podávat pacientům, u kterých selhala léčba imatinibem či nebyla tolerována. Účinnost je vysoká jak v počtu docílených cytogenetických, tak molekulárních odpovědí brzy po zahájení léčby. V ČR je dostupný pod názvem Tasigna. V rámci klinických studií, kterých se účastní také několik pracovišť z ČR, je podáván i pacientům s nově diagnostikovaným onemocněním.
V klinickém zkoušení je další inhibitor BCR-ABL TK druhé generace – bosutinib. Je účinný u mutantních forem rezistentních na imatinib (inhibuje rodinu Src kináz a fosforylaci STAT) a u pacientů s přítomnou mutací v kinázové doméně BCR-ABL T315I.
|
|
|
Závěrem
Nové léky typu inhibitorů tyrosinových kináz jsou obrovským přínosem v léčbě nemocných s CML, výrazně zlepšily také kvalitu jejich života. Jsou příkladem molekul schopných cíleně zasáhnout nádorové buňky a současně ušetřit buňky normální krvetvorby. Do budoucna se tak zřejmě otevírá úplně nová cesta léčby nádorových onemocnění na zcela jiném než cytostatickém principu.
Cílená léčba je v současné době dostupná všem nemocným v ČR, u nichž je indikována, tedy u kterých lze předpokládat její účinnost. Její podávání je vázáno na specializovaná pracoviště komplexní onkologické a hematoonkologické péče s možností monitorace kvality odpovědi na léčbu, včetně sledování tzv. zbytkové nemoci, metodami molekulárně biologickými. Cílená léčba CML tyrosinkinázovými inhibitory splňuje cíle, které si dává moderní onkologie i hematoonkologie, a to vracet nemocné zpět do života, rodinného prostředí a zaměstnání, a to s léčbou prováděnou většinou pouze v ambulantním režimu.
|
|
|
|
 |
obsah čísla 78 |
 |
ročník 2010 |
 |
témata |
|
|



